霍夫曼征对颈椎退变性疾病的临床价值
2021-08-04 文章来源:海军军医大学(第二军医大学)长征医院脊柱外科二病区 作者:孙凯强,史建刚 我要说
来源:海军军医大学(第二军医大学)长征医院脊柱外科二病区
作者:孙凯强,史建刚
颈椎退变性疾病是55岁以上人群最常见的颈椎病之一,该病临床上主要表现为脊髓的慢性压迫[1-2]。颈椎退变性疾病患者常常表现为反射亢进、肢体麻木、上肢感觉障碍和放射性症状[3],明显降低患者的独立生活能力和生活质量。
MRI是临床上诊断颈椎退变性疾病的重要手段。然而,在临床工作中,患者在首诊时往往只有普通的颈椎X线片,MRI检查往往需要较长的预约时间和较昂贵的费用。部分患者出现了明显的影像学变化,但其临床症状却不明显。因此,寻找一个反映脊髓损伤状态的可靠指标,不但能够使患者防患于未然,而且对于预测患者术后的恢复有重要价值。
霍夫曼征由Hans Curschmann在1911年首次提出[4]。研究发现霍夫曼征阳性能够提示上运动神经元损害[5]。霍夫曼征属于一种神经病理反射,对于颈椎病患者,霍夫曼征阳性往往提示颈脊髓损伤,一般同时伴有肌张力高、持物或走路不稳等锥体束征表现。研究表明霍夫曼征能够有效反映颈椎脊髓压迫的情况[6],有研究报道在其他疾病中也存在霍夫曼征,但一些颈椎退变性疾病患者并未表现出霍夫曼征[7-8]。本研究主要探究霍夫曼征与颈椎退变性疾病患者术前临床表现的关系及其对预测术后恢复的价值。
1 资料和方法
1.1 病例资料 回顾性分析2017年6月至2019年1月由于颈椎退变性疾病在我院接受颈椎前路减压融合术的201例颈椎退变性疾病患者的临床资料。纳入标准:(1)患者具有典型的颈椎脊髓压迫症状(上肢无力和麻木、手指灵活度降低、下肢行走不稳、神经性疼痛、大小便障碍及异常病理反射等)[2];(2)保守治疗6个月以上,患者症状无明显改善甚至加重;(3)临床资料记录完整;(4)不合并胸椎或腰椎部位的疾病;(5)MRI检查提示神经组织压迫。排除标准:(1)因其他疾病(创伤、感染或肿瘤)的脊柱手术史;(2)具有胸椎或腰椎神经组织压迫性症状;(3)具有其他神经系统疾病,如帕金森病或阿尔茨海默病;(4)具有脊柱畸形。
1.2 术前临床表现评估 患者临床常规体征检查包括霍夫曼征[3]、巴彬斯基征[9]、膝反射和跟腱反射,均由2位脊柱外科具有至少4年临床工作经验的主治医师在入院后2 h内,不知晓患者最初临床诊断、术前影像学信息的情况下独立完成。最终的诊断取决于2位医师一致的诊断结果,如果存在分歧则由通信作者做出最后决定。
1.3 临床评分和围手术期并发症评估 所有患者术后随访至少12个月。采用视觉模拟量表(visual analogue scale,VAS)评估患者的疼痛症状。采用日本骨科协会(Japanese Orthopaedic Association,JOA)评分、Nurick评分和颈椎功能障碍指数(neck disability index, NDI)评价神经功能症状,并计算JOA评分、Nurick评分和NDI评分的改善率:JOA评分改善率(%)=(术后JOA评分-术前JOA评分)/(17-术前JOA评分)×100%,Nurick评分(NDI评分)改善率(%)=(术前评分-术后评分)/术前评分×100%。为了探究霍夫曼征对于患者术前神经功能的影响,进一步分析JOA亚项(上肢和下肢运动功能、上肢和下肢感觉功能、躯干感觉、膀胱功能)评分,并记录患者围手术期并发症的发生情况。
1.4 统计学处理 应用GraphPad Prism 8软件进行统计学分析。呈正态分布的计量资料以`x±s表示,两组比较采用独立样本t检验。呈偏态分布的计量资料以中位数(范围)表示,两组比较采用Mann-Whitney U检验。计数资料以例数和百分数表示,两组比较采用χ2检验和Fisher's 确切概率法。采用ROC曲线评估霍夫曼征预测临床评分的灵敏度和特异度。检验水准(a)为0.05。
2 结果
2.1 一般资料 共104例患者入组,其中霍夫曼征阳性组49例,男36例、女13例,年龄为54(32~77)岁;霍夫曼征阴性组55例,男32例、女23例,年龄为56(28~78)岁。两组患者的性别、年龄、随访时间差异均无统计学意义(P均>0.05)。相比霍夫曼征阴性组,霍夫曼征阳性组患者术前有较长的临床症状周期(P<0.01)。关于脊髓压迫水平,两组患者均以C4/5和C5/6节段最常见。与霍夫曼征阴性组相比,霍夫曼征阳性组患者具有更高比例的膝反射亢进、跟腱反射亢进和脊髓高信号影(P均<0.05)。在临床诊断方面,霍夫曼征阳性组脊髓型颈椎病31例(63.3%)、颈椎管狭窄症22例(44.9%)、神经根型颈椎病1例(2.0%),霍夫曼征阴性组脊髓型颈椎病12例(21.8%)、颈椎管狭窄症33例(60.0%)、神经根型颈椎病6例(10.9%),两组患者术前临床诊断差异有统计学意义(P=0.001)。见表1。
表1 两组患者的一般资料比较
Item | Negative N=55 | Positive N=49 | Statistic | P value |
Gender, n (%) |
| χ2=2.676 | 0.102 | |
Male | 32 (58.2) | 36 (73.5) |
| |
Femal | 23 (41.8) | 13 (26.5) |
| |
Age/year, median (range) | 56 (28-78) | 54 (32-77) | U=846.5 | 0.859 |
During of symptoms/month, median (range) | 14.0 (0.5-120.0) | 12.0 (1.0-156.0) | U=846.5 | 0.001 |
Clinical diagnosis, n (%) |
|
| χ2=18.911 | <0.01 |
Cervicalspondylotic myelopathy | 12 (21.8) | 31 (63.3) |
|
|
Cervical spinal stenosis | 33 (60.0) | 12 (24.5) |
|
|
Cervical spondylotic radiculopathy | 10 (18.2) | 6 (12.2) |
|
|
Follow-up period/month, `x±s | 16.0±3.9 | 16.7±5.2 | t=0.582 | 0.563 |
Knee hyperreflexia, n (%) | 34 (61.8) | 48 (98.0) | χ2=20.294 | <0.01 |
Achilles tendon hyperreflexia, n (%) | 15 (27.3) | 35 (71.4) | χ2=20.240 | <0.01 |
Compressed level, n (%) |
| χ2=6.090 | 0.193 | |
C2/3 | 5 (9.1) | χ2=4.680 | 0.059 | |
C3/4 | 36 (65.5) | 31 (63.3) | χ2=0.054 | 0.816 |
C4/5 | 44 (80.0) | 42 (85.7) | χ2=0.591 | 0.442 |
C5/6 | 51 (92.7) | 46 (93.9) | χ2=0.055 | >0.999 |
C6/7 | 39 (70.9) | 24 (49.0) | χ2=5.218 | 0.022 |
Intramedullary hyperintensity, n (%) | 20 (36.4) | 29 (59.2) | χ2=5.416 | 0.027 |
Clinical score |
|
| ||
JOA score, `x±s | 12.3±2.8 | 10.8±2.7 | t=2.092 | 0.040 |
Nurick score, median (range) | 2.0 (1.0-5.0) | 3.0 (1.0-5.0) | U=411.0 | <0.01 |
NDI score, median (range) | 18.0 (5.0-33.0) | 18.0 (4.0-33.0) | U=736.5 | 0.781 |
VAS score, median (range) | 4.0 (0.0-10.0) | 4.0 (0.0-10.0) | U=660.5 | 0.292 |
2.2 临床评分 相比霍夫曼征阴性组,霍夫曼征阳性组患者术前有较差的JOA评分和Nurick评分(P<0.05),但两组患者术前VAS评分和NDI评分比较差异均无统计学意义(表1)。ROC曲线分析结果(图1)显示,霍夫曼征可作为患者术前临床评分的预测指标,其预测术前JOA评分的灵敏度为85.29%,特异度为42.22%,AUC为0.666(95%CI 0.547~0.785,p=0.112);预测Nurick评分的灵敏度为67.65%,特异度为75.56%,AUC为0.731(95% CI 0.618~0.845,P<0.01)。
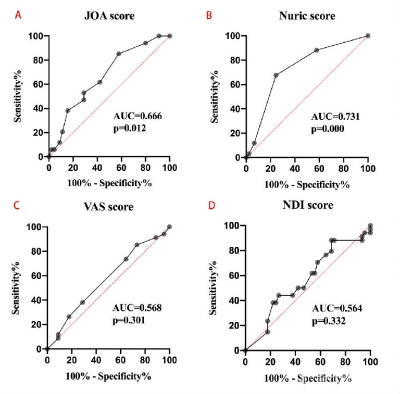
图1 霍夫曼征预测临床评分的ROC曲线
JOA亚项评分分析结果(表2)显示,与霍夫曼征阴性组相比,霍夫曼征阳性组患者的术前上肢运动功能和下肢感觉功能均较差(p均<0.01)。ROC曲线分析结果(图2)显示,霍夫曼征预测上肢运动功能的灵敏度为47.06%,特异度为80.00%,AUC为0.731(95% CI 0.561~0.798,P=0.006);预测下肢运动功能的灵敏度为79.41%,特异度为44.44%,AUC为0.629(95% CI 0.506~0.753,P=0.050);预测下肢感觉功能的灵敏度为44.12%,特异度为84.45%,AUC为0.660(95% CI 0.536~0.783,P=0.016)。
表2 两组患者的术前JOA亚项评分比较
Item | Negative N=55 | Positive N=49 | Statistic | P value |
Upper extremity |
|
| ||
Motor function, `x±s | 2.9±0.6 | 2.4±0.6 | t=3.518 | 0.001 |
Sensory function, median (range) | 0.0 (0.0-2.0) | 0.0 (0.0-1.0) | U=674.0 | 0.269 |
Low extremity |
|
| ||
Motor function, median (range) | 3.0 (0.0-4.0) | 3.0 (2.0-4.0) | U=663.0 | 0.293 |
Sensory function, median (range) | 2.0 (0.0-3.0) | 1.0 (0.0-2.0) | U=521.0 | 0.009 |
Sensory function of trunk, median (range) | 2.0 (0.0-3.0) | 2.0 (0.0-2.0) | U=747.0 | 0.832 |
Bladder function, median (range) | 3.0 (1.0-3.0) | 3.0 (1.0-3.0) | U=719.0 | 0.493 |
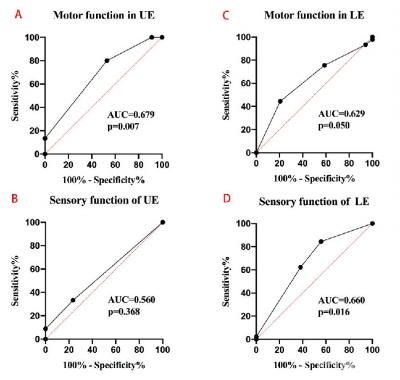
图2 霍夫曼征预测JOA亚项评分ROC曲线
2.3 术后临床评分和围手术期并发症 末次随访时,霍夫曼征阳性组患者的JOA评分和Nurick评分及其恢复率与霍夫曼征阳性组相比均较低(P均<0.05),但两组患者的NDI评分和VAS评分差异均无统计学意义(P均>0.05,表3)。JOA亚项评分分析结果显示,霍夫曼征阳性组患者末次随访时上肢运动功能和下肢感觉功能得分与霍夫曼征阴性组患者相比均较低[3.5(2.0~4.0)分 vs 4.0(3.0~4.0)分、2.0(0.0~2.0)分 vs 2.0(1.0~3.0)分],差异均有统计学意义(p均<0.05);而上肢感觉功能和下肢运动功能得分与霍夫曼征阴性组相比[1.0(0.0~2.0)分 vs 2.0(0.0~2.0)分、4.0(2.0~4.0)分 vs 4.0(2.0~4.0)分]差异均无统计学意义(P均>0.05)。对于围手术期并发症,霍夫曼征阳性组3例患者出现C5神经根麻痹,3例表现出轴性疼痛,5例出现吞咽困难,2例表现出声音嘶哑,1例出现神经功能恶化;霍夫曼征阴性组患者中1例出现C5神经根麻痹,3例表现出轴性疼痛,4例出现吞咽困难,2例表现出声音嘶哑,1例患者出现神经功能恶化。两组患者围手术期并发症的发生率差异无统计学意义(P>0.05,表3)。
表3 两组患者的术后末次随访临床评分和围手术期并发症比较
Item | Negative N=55 | Positive N=49 | Statistic | P value |
Clinical scores |
|
| ||
JOA score, median (range) | 16.0 (13.0-17.0) | 15.0 (7.0-17.0) | U=540.5 | 0.021 |
Nurick score, median (range) | 0.0 (0.0-5.0) | 1.0 (0.0-3.0) | U=340.0 | <0.01 |
VAS score, median (range) | 2.0 (0.0-8.0) | 2.0 (0.0-8.0) | U=669.0 | 0.313 |
NDI score, median (range) | 6.0 (0.0-22.0) | 7.0 (0.0-30.0) | U=742.5 | 0.826 |
Recovery rate/%, median (range) |
|
| ||
JOA score | 75.0 (40.1-100.0) | 63.0 (17.0-100.0) | U=532.0 | 0.017 |
Nurick score | 100.0 (0.0-100.0) | 36.5 (0.0-100.0) | U=386.0 | <0.00 |
NDI score | 63.0 (27.4-100.0) | 58.0 (15.3-100.0) | U=672.0 | 0.359 |
Complications, n (%) |
| χ2=0.762 | 0.944 | |
C5 nerve palsy | 1 (1.8) | 3 (6.1) |
| |
Axial pain | 3 (5.5) | 3 (6.1) |
| |
Dysphagia | 4 (7.3) | 5 (10.2) |
| |
Hoarseness | 2 (3.6) | 2 (4.1) |
| |
Neurological deterioration | 1 (1.8) | 1 (2.0) |
|
为进一步探究霍夫曼征与术后神经功能恢复的关系,根据JOA评分的恢复率将患者分为恢复率≥75%和<75%两组,分别53和51例。如表4所示,与JOA评分恢复率≥75%组相比,JOA评分恢复率<75%组患者表现出较高的霍夫曼征阳性率和脊髓高信号发生率(P均<0.05),较低的术前JOA和JOA亚项评分,以及较低的Nuric和NDI评分(P均<0.05),表明术后神经功能恢复与术前神经功能状态关系密切。
表4 基于JOA评分恢复率分组行前路减压融合术患者的临床参数
Item | Recovery rate<75% N=51 | Recovery rate≥75% N=53 | Statistic | P value |
Hoffman sign, n (%) | χ2=5.506 | 0.019 | ||
Positive | 30 (58.8) | 19 (35.8) |
| |
Negative | 21 (41.2) | 34 (64.2) |
| |
During of symptoms/month, median (range) | 9.0 (0.5-156) | 5.0 (0.5-120.0) | U=688.0 | 0.398 |
Intramedullary hyperintensity, n (%) | 30 (58.8) | 19 (35.8) | χ2=5.506 | 0.019 |
Preoperative clinical score |
| |||
JOA score, `x±s | 9.6±2.5 | 13.3±1.7 | t=7.682 | <0.01 |
Nurick score, `x±s | 2.6±1.0 | 1.9±0.9 | t=3.220 | 0.002 |
NDI score, median (range) | 19.0 (5.0-42.0) | 16.0 (4.0-33.0) | U=502.0 | 0.007 |
VAS score, median (range) | 4.0 (0.0-10.0) | 4.0 (0.0-10.0) | U=761.0 | 0.898 |
Preoperative JOA in isolation |
| |||
Motor function of UE, median (range) | 2.0 (1.0-3.0) | 3.0 (1.0-4.0) | U=356.0 | <0.01 |
Motor function of LE, `x±s | 2.6±1.0 | 3.3±0.8 | t=3.582 | 0.001 |
Sensory function of UE, median (range) | 0.0 (0.0-1.0) | 0.0 (0.0-2.0) | U=472.5 | <0.01 |
Sensory function of LE, median (range) | 0.0 (0.0-2.0) | 2.0 (0.0-3.0) | U=351.0 | <0.01 |
3 讨论
霍夫曼征阳性的患者术前多表现为更长的症状周期
霍夫曼征阳性通常提示上运动神经元病变,然而其与脊髓损伤严重程度的关系目前仍存在争议。有学者研究报道,症状周期与脊髓损伤的严重程度密切相关,症状周期越短术前神经功能状态越好[10]。Basques等[11]研究发现症状周期为6个月以上的患者术前神经功能状态一般较差。也有文献报道症状周期是患者术后预后最重要的预测指标之一,术前症状周期越长,患者术后的神经功能恢复越差。Burneikiene等[12]研究发现患者术前症状周期越短术后神经功能恢复越满意,同时就诊5个月以内接受外科减压术的患者术后神经功能恢复更好。Tarazona等[13]通过多因素分析发现症状周期为12个月以上的患者预后较差。最新研究表明症状周期并不影响患者的术前神经功能状态和术后恢复,然而进一步评估患者的最小有临床意义的差值时发现推迟的手术治疗将延缓患者术后神经功能的恢复[14]。同样,Tetreault等[15]通过一项前瞻性研究发现在症状出现4个月以内接受手术治疗的患者预后更好。本研究通过探究霍夫曼征与患者临床表现的关系发现,霍夫曼征阳性的患者术前神经功能恶化周期更长,推测对脊髓更长时间的压迫往往造成更严重的脊髓损伤,有可能损伤脊髓内部神经元结构,导致患者出现霍夫曼征。
霍夫曼征阳性有助于预测患者的上肢运动功能和下肢感觉功能
多项研究曾探究霍夫曼征与临床结果的相关性。Houten等[15]报道具有外科治疗指征的患者比保守治疗的患者具有更多风险发展为霍夫曼征阳性。而且,本研究结果也显示霍夫曼征阳性的患者术前神经功能状态更差(JOA评分),这与既往文献报道[16]一致。进一步的ROC曲线分析表明霍夫曼征阳性对术前JOA评分有较高的灵敏性,对Nurick评分有较高的特异性。Grijalva等[16]报道霍夫曼征阳性可以预测脊髓压迫,具有较高的灵敏性。然而本研究进一步分析JOA亚项评分的结果显示,霍夫曼征阳性患者具有更差的术前上肢运动功能和下肢感觉功能,且对该2项功能的预测能力较高。从解剖学角度,脊髓前束支配肢体的运动功能,脊髓丘脑侧束支配肢体的感觉功能,这2个功能单位束均位于脊髓的前侧部,提示霍夫曼征的产生与此解剖学部位有关。因此,认为霍夫曼征阳性可作为患者术前神经功能状态和手术指征的良好指标,对于此类的病人在术后康复锻炼中可以增加对上肢运动功能和下肢感觉功能的关注。但是具体是何种机制导致霍夫曼征仅与上肢运动及下肢感觉功能有关,目前难以明确。未来相关的基础研究和解剖研究或许将有利于揭示霍夫曼征的具体发生机制及其与临床表征的关系。
霍夫曼征阳性与反射亢进和脊髓内高信号密切相关
脊髓损伤是颈椎退变性疾病的重要表现,常伴随异常的反射活动。Handal[17]报道所有反射亢进的患者均表现为霍夫曼征阳性和神经受压。本研究结果显示,表现为膝反射亢进或腱反射亢进的患者有更高的霍夫曼征阳性率。推测这些反射亢进和霍夫曼征可能与脊髓的上运动神经元病变有关。此处,髓内高信号也与脊髓损伤关系密切,本研究中霍夫曼征阳性患者的脊髓高信号发生率是59.18%(29/49),高于霍夫曼征阴性的患者(36.36%,20/55)。Aria等[18]开展的一项前瞻性多中心研究发现霍夫曼征多出现在有严重脊髓压迫和髓内高信号的患者。Rhee等[19]利用ROC曲线分析霍夫曼征与Nurick评分的关系,结果显示霍夫曼征可作为评估颈椎脊髓病变的一个临床初筛工具。
霍夫曼征可作为术后预后较差的预测指标之一
本研究也评估了霍夫曼征与患者术后神经功能恢复的关系,在末次随访时,霍夫曼征阳性组患者的神经功能恢复(JOA评分和Nurick评分)较阴性组差,JOA评分和Nurick评分的恢复率也较低,表明霍夫曼征可作为术后预后较差的一个预测指标。同时JOA亚项评分分析结果显示,霍夫曼征阳性组患者的术后上肢运动功能和下肢感觉功能恢复较阴性组差,结果JOA恢复率的分组分析结果,认为临床神经功能恢复差与术前神经功能状态差的关系密切。
体格检查联和影像学检查有助于确诊颈椎退变性疾病
还有一个问题需要指出,霍夫曼征也可能出现在无症状患者,发生率为1.63%~2%[20-22]。所有个体在其一生中都有可能发生颈椎退行性改变,颈椎脊髓压迫和信号改变也可能存在于无症状患者或40岁以上的个体[23-25]。Boden等[26]曾报道在63例无症状患者中,约19%有椎间孔狭窄或椎间盘突出。Cook等[7]指出尽管常规的临床测试有更高的特异性,但灵敏性较低,很难作为常规筛选工具。说明仅依靠临床体格检查并不能做出最后诊断,对于疑似颈椎退变性疾病患者,适当的影像学检查非常必要。
本研究的3个局限性和结论
本研究存在以下局限性:(1)没有评估霍夫曼征在患者术后随访中的变化状态(消失还是持续存在),因此并不能得出霍夫曼征的变化与临床恢复相关。(2)所有纳入的患者均进行了颈椎MRI检查,但是并未常规行脑部MRI检查。文献报道脑部损伤患者也可能出现霍夫曼征[6]。然而,Grijalva等[16]的回顾性研究表明91例霍夫曼征阳性的患者中仅2例存在脑部病变,提示霍夫曼征与脑部病变的关系并不密切。因此,对于霍夫曼征阳性而没有脊髓病变的患者,不建议常规行脑部MRI检查。(3)很多患者初诊时,往往携带当地医院的影像学资料,往往导致临床检查和影像学检查时间不一致,也会对研究结果造成影响。
因此,霍夫曼征阳性的患者可能有较差术前神经功能和术后恢复。霍夫曼征与上肢运动功能和下肢感觉功能的恢复关系密切,对它们有较好的预测价值。然而,未来需要更高证据等级的研究和更长的随访时间来进一步探究霍夫曼征和患者神经功能的相关性。
[参考文献][1] NOURI A, TETREAULT L, SINGH A, KARADIMAS S K, FEHLINGS M G. Degenerative cervical myelopathy: epidemiology, genetics, and pathogenesis[J/OL]. Spine, 2015, 40: E675-E693. DOI: 10.1097/BRS.0000000000000913.
[2] KALSI-RYAN S, RIEHM L E, TETREAULT L, MARTIN A R, TEODERASCU F, MASSICOTTE E, et al. Characteristics of upper limb impairment related to degenerative cervical myelopathy: development of a sensitive hand assessment (graded redefined assessment of strength, sensibility, and prehension version myelopathy)[J/OL]. Neurosurgery, 2020, 86: E292-E299. DOI: 10.1093/neuros/nyz499.
[3] COOK C, ROMAN M, STEWART K M, LEITHE L G, ISAACS R. Reliability and diagnostic accuracy of clinical special tests for myelopathy in patients seen for cervical dysfunction[J]. J Orthop Sports Phys Ther, 2009, 39: 172-178.
[4] MALANGA G A, LANDES P, NADLER S F. Provocative tests in cervical spine examination: historical basis and scientific analyses[J]. Pain Physician, 2003, 6: 199-205.
[5] GLASER J A, CURÉ J K, BAILEY K L, MORROW D L. Cervical spinal cord compression and the Hoffmann sign[J]. Iowa Orthop J, 2001, 21: 49-52.
[6] TEJUS M N, SINGH V, RAMESH A, KUMAR V R, MAURYA V P, MADHUGIRI V S. An evaluation of the finger flexion, Hoffman's and plantar reflexes as markers of cervical spinal cord compression-A comparative clinical study[J]. Clin Neurol Neurosurg, 2015, 134: 12-16.
[7] COOK C E, WILHELM M, COOK A E, PETROSINO C, ISAACS R. Clinical tests for screening and diagnosis of cervical spine myelopathy: a systematic review[J]. J Manipulative Physiol Ther, 2011, 34: 539-546.
[8] MADONICK M J. Statistical control studies in neurology. Ⅲ. The Hoffman sign[J]. AMA Arch Neurol Psychiatry, 1952, 68: 109-115.
[9] Hindfelt B, Rosén I, Hanko J. The significance of a crossed extensor hallucis response in neurologic disorders: a comparison with the Babinski sign[J]. Acta Neurol Scand, 1976, 53: 241-250.
[10] KARPOVA A, ARUN R, DAVIS A M, KULKARNI A V, MASSICOTTE E M, MIKULIS D J, et al. Predictors of surgical outcome in cervical spondylotic myelopathy[J]. Spine (Phila Pa 1976), 2013, 38: 392-400.
[11] BASQUES B A, AHN J, MARKOWITZ J, HARADA G, LOUIE P K, MORMOL J, et al. Does the duration of cervical radicular symptoms impact outcomes after anterior cervical discectomy and fusion?[J]. Clin Spine Surg, 2019, 32: 387-391.
[12] Burneikiene S, Nelson E L, Mason A, Rajpal S, Villavicencio A T. The duration of symptoms and clinical outcomes in patients undergoing anterior cervical discectomy and fusion for degenerative disc disease and radiculopathy[J]. Spine J, 2015, 15: 427-432.
[13] TARAZONA D, BOODY B, HILIBRAND A S, STULL J, BELL K, FANG T L, et al. Longer preoperative duration of symptoms negatively affects health-related quality of life after surgery for cervical radiculopathy[J]. Spine, 2019, 44: 685-690.
[14] JENKINS N W, PARRISH J M, LYNCH C P, CHA E D K, MOHAN S, GEOGHEGAN C E, et al. The association of preoperative duration of symptoms with clinical outcomes and minimal clinically important difference following anterior cervical discectomy and fusion[J]. Clin Spine Surg, 2020, 33: 378-381.
[15] HOUTEN J K, NOCE L A. Clinical correlations of cervical myelopathy and the Hoffmann sign[J]. J Neurosurg Spine, 2008, 9: 237-242.
[16] GRIJALVA R A, HSU F P K, WYCLIFFE N D, TSAO B E, WILLIAMS P, AKPOLAT Y T, et al. Hoffmann sign: clinical correlation of neurological imaging findings in the cervical spine and brain[J]. Spine, 2015, 40: 475-479.
[17] HANDAL J. The validity of clinical tests in the diagnosis of cervical myelopathy[C]. The annual meeting of the North American Spine Society, San Francisco, California, October 30, 1998.
[18] NOURI A, TETREAULT L, DALZELL K, ZAMORANO J J, FEHLINGS M G. The relationship between preoperative clinical presentation and quantitative magnetic resonance imaging features in patients with degenerative cervical myelopathy[J]. Neurosurgery, 2017, 80: 121-128.
[19] RHEE J M, HEFLIN J A, HAMASAKI T, FREEDMAN B. Prevalence of physical signs in cervical myelopathy: a prospective, controlled study[J]. Spine, 2009, 34: 890-895.
[20] FAY T, GOTTEN H B. Clinical observations on the value of the Hoffmann sign[J]. J Nerv Ment Dis, 1933, 77: 594-600.
[21] ECHOLS D H. The Hoffmann sign[J]. J Nerv Ment Dis, 1936, 84: 427-431.
[22] SUNG R D, WANG J C. Correlation between a positive Hoffmann's reflex and cervical pathology in asymptomatic individuals[J]. Spine (Phila Pa 1976), 2001, 26: 67-70.
[23] Kato F, Yukawa Y, Suda K, Yamagata M, Ueta T. Normal morphology, age-related changes and abnormal findings of the cervical spine. Part Ⅱ: magnetic resonance imaging of over 1,200 asymptomatic subjects[J]. Eur Spine J, 2012, 21: 1499-1507.
[24] NAGATA K, YOSHIMURA N, MURAKI S, HASHIZUME H, ISHIMOTO Y, YAMADA H, et al. Prevalence of cervical cord compression and its association with physical performance in a population-based cohort in Japan: the Wakayama Spine Study[J]. Spine (Phila Pa 1976), 2012, 37: 1892-1898.
[25] NAGATA K, YOSHIMURA N, HASHIZUME H, MURAKI S, ISHIMOTO Y, YAMADA H, et al. The prevalence of cervical myelopathy among subjects with narrow cervical spinal canal in a population-based magnetic resonance imaging study: the Wakayama Spine Study[J]. Spine J, 2014, 14: 2811-2817.
[26] Boden S D, McCowin P R, Davis D O, Dina T S, Mark A S, Wiesel S. Abnormal magnetic-resonance scans of the cervical spine in asymptomatic subjects. A prospective investigation[J]. J Bone Joint Surg Am, 1990, 72: 1178-1184.
作者简介

孙凯强
• 海军军医大学附属长征医院脊柱外科第二病区博士研究生
• 荣誉奖励:荣立个人三等功一次,优秀学员6次等
• 科研成果:目前以第一作者和共同第一作者在Frontiers in Immunology,Oxidative Medicine and Cellular Longevity,Cell cycle等杂志共发表SCI论文30篇,单篇最高影响因子7.56分,累计影响因子93.089分。第一作者发表中文核心期刊7篇(中华医学系列2篇)。参编专著3部,其中作为主编助理参编专著一部《脊柱:结构、功能与疾病(军队版)》。独立执笔撰写国基金面上项目两项(均中标)。授权国家发明专利1项(第三位),实审公开国家发明专利5项(均为第三位),授权实用新型专利10项(均为第三位)

史建刚
• 主任医师、教授、博士生导师, 海军军医大学附属长征医院脊柱外科第二病区主任
• 学术专长:颈椎病、腰椎病的外科治疗及微创治疗;脊柱韧带骨化症(颈椎后纵韧带骨化、胸椎后纵韧带骨化、黄韧带骨化);脊柱脊髓发育性畸形(脊髓栓系综合征、半椎体畸形等);腰骶神经弓弦疾病
• 学术任职:中华医学会骨科学分会脊柱学组委员;中国医药教育协会骨科脊柱分会主任委员
• 主要荣誉:发表文章100余篇,SCI 70余篇;主编专著6部,在编3部;获国家、军队及省部级课题10余项;获国家、军队及省部级奖项10余项;获国家发明及实用新型专利30余项;荣立个人三等功2次;上海市领军人才;上海市“新百人”;2021年荣获上海市科技进步一等奖


 京公网安备11010502051256号
京公网安备11010502051256号